中大新聞中心
中大學者揭示調控神經幹細胞分化能力新機制為幹細胞治療及再生醫學開拓新方向
香港中文大學(中大)生命科學學院副教授關健明教授領導的研究團隊最近發現一種嶄新的神經幹細胞調控機制,為神經系統的發育及再生修復研究提供新方向,更有助發展相關疾病的治療方案,包括自閉症譜系障礙及遺傳性小腦萎縮症。研究結果最近在國際著名學術期刊《細胞報導》(Cell Reports)上發表。
部分神經系統疾病與神經元數量有關
腦部是動物的指揮中心,由數以百億計、不同類型的神經元組成。人類的腦部便有着數百種不同的神經元,各有專門的用途,但它們都是透過位於腦部特定區域的一小撮神經幹細胞分化形成。
神經幹細胞在不同的發育階段,會按照預設的時間順序,表達特定的轉錄因子基因,分化成不同種類的神經元。神經元數量的失調會損害神經網絡的運作,導致中樞神經系統病變。很多常見的神經系統疾病,如自閉症譜系障礙及遺傳性小腦萎縮症等,其病理機制都與神經元數目的缺失有密切關係。因此,研究調控神經幹細胞分化的機制是治療各類腦部發育缺陷、神經退化疾病,甚至修復腦部創傷的重要關鍵。然而,如何控制神經幹細胞分化的時間表從而誘導特定神經元的生成,一直是科學界重大的謎團。
揭示缺乏或增加細胞外信息因子會阻礙幹細胞分化
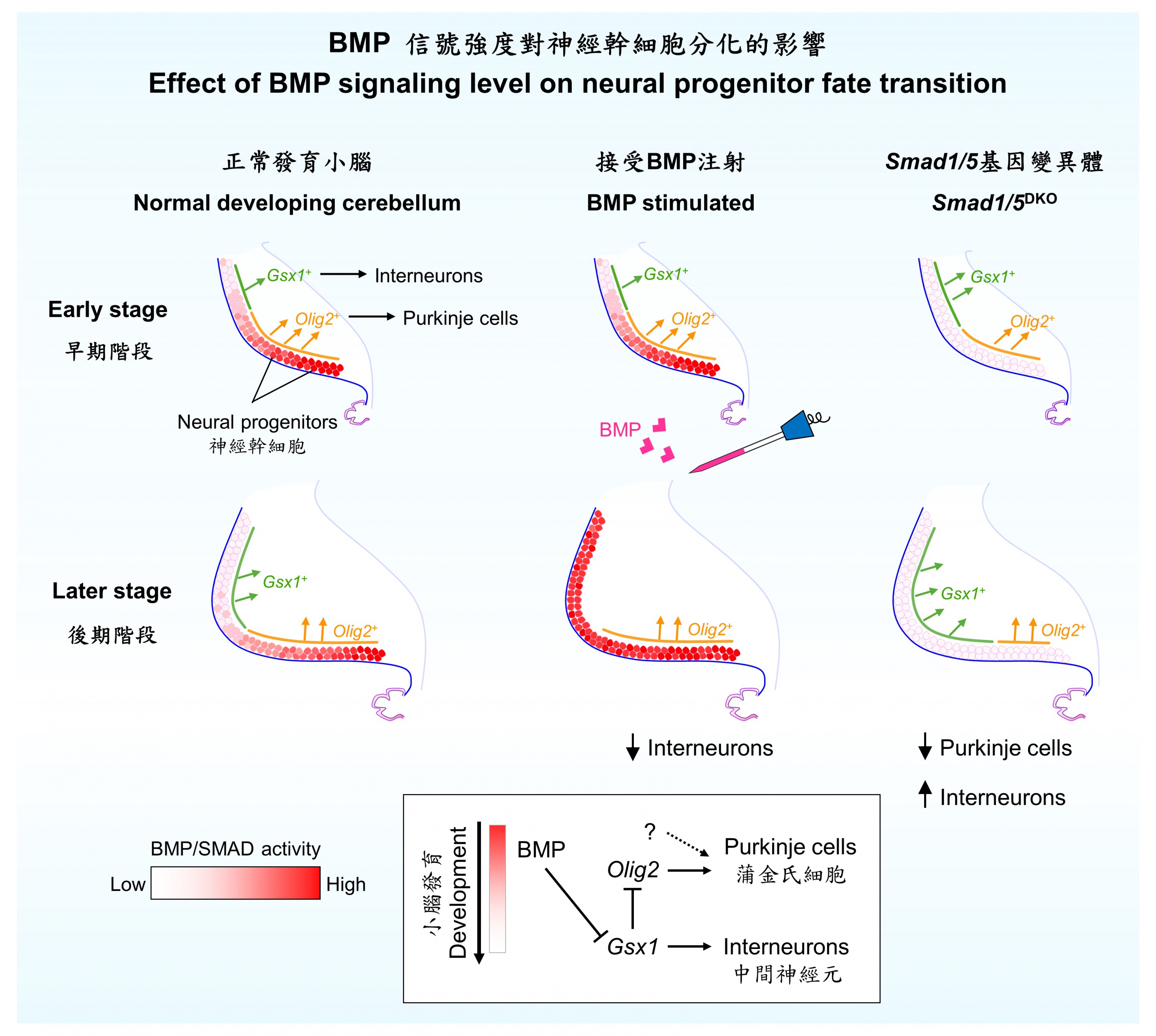
以小腦的發育為例,早期階段的幹細胞會分化成蒲金氏細胞 (Purkinje cells)。但隨着時間推移,幹細胞逐漸失去這種分化潛力並轉而生成中間神經元(interneurons)。研究團隊發現,神經幹細胞的分化潛力會隨着BMP信號強度下降而消失。
研究團隊透過小鼠活體實驗,發現當缺少了兩種BMP信息傳導蛋白 — Smad1和Smad5,神經幹細胞分化成蒲金氏細胞的能力會不尋常地加速消失,最終導致小腦內蒲金氏細胞數量顯著減少,中間神經元的數量大幅上升。研究團隊並確定Smad1和Smad5能夠直接抑制下游基因Gsx1,而Gsx1的表達則會使神經幹細胞喪失分化潛力。因此,研究人員嘗試透過注射BMP信息因子到小鼠胚胎的腦脊液,發現成功延緩幹細胞潛能下降的速度,繼而調整特定不同神經元數量的比例。
關教授解釋:「科學界此前一直未能掌握避免神經幹細胞分化潛力下降的機制。我們的研究首次發現在哺乳類動物的腦部中,細胞外信息因子的強度對於神經幹細胞分化成不同種類神經元的潛力有關鍵作用。單單透過改變信息因子的數量,已可以調節神經幹細胞分化的時間表,這對研發幹細胞治療的方案別具意義。下一步我們將朝此方向探討應用至臨床再生醫學的可行性。」
此項目獲得研究資助局的卓越學科領域計劃和優配研究金資助,亦是中大農業生物技術國家重點實驗室和細胞及發育生物學研究中心的研究項目。
關健明教授簡歷
關健明教授現為中大理學院副院長(教育)、自然科學課程主任及生命科學學院副教授。關教授於香港大學取得學士及博士學位,並於美國德州大學安德森癌症中心擔任博士後研究員。自2006年開始,關教授便致力研究小腦神經細胞發展的基因調控,及其與小腦萎縮症的關係。關教授於2006年加入中大,2008年獲中大青年學者研究成就獎,並分別於2009及2013年獲得中大理學院傑出教學獎。
註:
Spatiotemporal Decline of BMP Signaling Activity in Neural Progenitors Mediates Fate Transition and Safeguards Neurogenesis, Cell Reports
https://www.cell.com/cell-reports/fulltext/S2211-1247(20)30263-1